Trenquem l’ou i separem les clares dels rovells. Agafem una vareta i batem amb energia o, si volem anar més de pressa, ens ajudem amb una batedora. De mica en mica, el líquid es torna més blanquinós i espès, i arriba un moment on l’escuma de les clares és tan densa que, per molt que posem el bol cap per avall, és impassible a la gravetat. Màgia!
Què ha passat? Quina part de les clares és la responsable d’aquest fenomen? Per poder respondre aquestes preguntes, ens endinsarem al món de les proteïnes.
De ben segur que n’has sentit a parlar, però saps què són les proteïnes?
Podríem dir que les cèl·lules són incansables “fàbriques de proteïnes”. De fet, sense tenir en compte el percentatge d’aigua (70 %), estem formats majoritàriament per proteïnes (16 %). Dit d’altra manera, funcionem gràcies a elles. Són les qui fan tota feina del cos: ens ajuden a degradar compostos, generar energia i mantenir els equilibris necessaris per viure.
Ara bé, les proteïnes no apareixen de forma espontània! Si les cèl·lules fossin fàbriques de mobles, podríem dir que les proteïnes són taules, cadires, armaris… Per construir-los, necessitem material i instruccions que ens diguin com muntar-les amb precisió.
El manual d’instruccions és el famosíssim DNA. El problema és que els operaris que munten els mobles, els ribosomes, són incapaços d’entendre l’alfabet en què està escrit el manual —imaginem que està escrit en l’alfabet fonètic. Per sort, però, hi ha uns encarregats de transcriure’l a l’alfabet dels ribosomes —posem per cas el llatí—: les RNA polimerases, que permeten que els ribosomes siguin capaços d’entendre el missatge (RNA) i construir l’armari, és a dir, la proteïna.
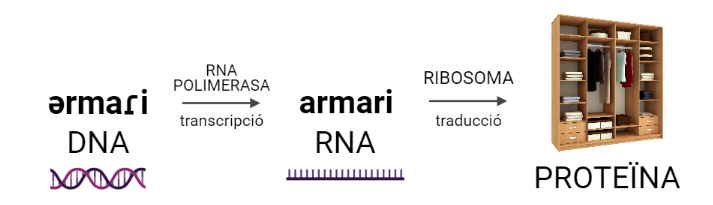
Les proteïnes són combinacions de 20 aminoàcids organitzats
Si bé la informació del DNA està escrita amb només 4 nucleòtids (Adenina, Citosina, Guanina i Timina), com pots veure en aquest article, les proteïnes les conformen una mescla de 20 aminoàcids diferents. Dit d’altra manera, si tornem a l’analogia de la fàbrica, podríem dir que hi ha 20 tipus diferents de peces amb què construir els mobles.
Si estàs pensant a quin altre context has sentit aquesta paraula, segurament estigui relacionat amb el menjar: “és un aliment ric en aminoàcids!”. I és que una part important dels aminoàcids que necessitem l’adquirim amb la dieta. Aquestes peces, els aminoàcids, són la base de les proteïnes i, per tant, essencials pel bon funcionament de tots els processos del cos.
A les proteïnes, aquestes peces es col·loquen segons els dicten els operaris (ribosomes), de manera ordenada, l’un rere l’altre, formant una espècie de collaret de perles. Això es coneix com a estructura primària. Tot i això, les propietats més interessants de les proteïnes tenen lloc gràcies a les estructures secundària i sobretot la terciària, gràcies a la qual adopten la forma de “pilota”.
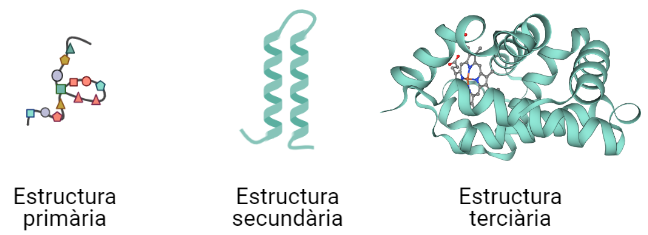
L’estructuració en l’espai dels aminoàcids es dona per les seves propietats característiques
Cadascun dels 20 aminoàcids té unes propietats singulars que són les responsables de l’estructura final de la proteïna. L’organització en l’espai dels aminoàcids es dona segons les afinitats entre ells i l’entorn on es troben. Segons l’ordre en què disposin els aminoàcids a l’estructura primària, tindran tendència a formar unes formes o unes altres. Per exemple, les hèlixs alfa o els fulls beta, com veieu a la imatge. Amb això, ja tenim l’estructura secundària.
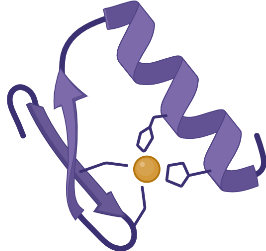
Alhora, les interaccions entre els aminoàcids més o menys llunyans fan que la proteïna es plegui sobre si mateixa. És llavors quan s’assoleix l’estructura terciària, amb un conjunt de seccions —fulles beta i/o hèlix alfa— prou estables. A vegades però, no n’hi ha prou amb les interaccions entre aminoàcids i calen ions, com el de zinc de la imatge, per estabilitzar les estructures.
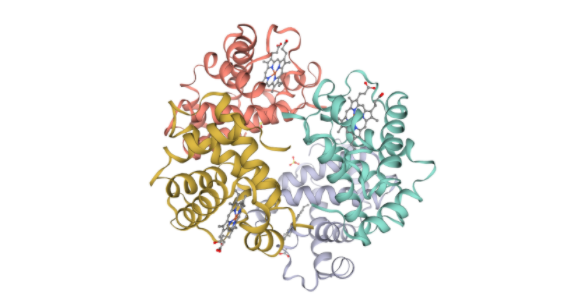
Hi ha proteïnes, però, que encara van més enllà, perquè presenten una estructura quaternària. Un exemple molt conegut és l’hemoglobina, que dona el color vermell característic a la sang i que és formada per quatre subunitats diferents, és a dir, per quatre collarets de perles amb estructura terciària diferents, estabilitzades per quatre ions de ferro.
Ara que ja coneixem l’estructura 3D de les proteïnes, centrem-nos en les propietats dels aminoàcids que els porten a tenir aquesta organització.
Els aminoàcids es poden agrupar en diferents grups en funció de les seves propietats: apolars, polars, bàsics o àcids. Aquestes propietats, juntament amb l’entorn, són les que marquen en gran manera com s’ordenen en l’espai. Ens fixarem en els dos primers, els polars i apolars.
Les proteïnes a la cuina
La cuina està plena de compostos polars i apolars. El cas més il·lustratiu és el de l’aigua i l’oli. I és que tots, en algun moment o altre, hem provat de mesclar-los, però renoi, no hi ha manera! L’únic que aconseguirem és formar una interfase entre les capes d’oli i aigua on trobem els dos compostos en més o menys proporció. Això passa perquè l’oli és apolar i no li agrada l’aigua, que és polar. Els compostos polars busquen entorns polars i els compostos apolars busquen entorns apolars.
Són polars els compostos que se senten atrets per l’aigua i apolars aquells que la repel·leixen
Així doncs, podem deduir que els aminoàcids polars tendeixen a buscar l’aigua mentre que els apolars en fugen. Però l’entorn en què es troben les proteïnes està format majoritàriament d’aigua. Sabent això, hem de fer un esforç per imaginar-nos les proteïnes com si fossin pilotes. Aquesta forma de pilota és una organització estabilitzadora, que disposa els aminoàcids polars a l’exterior i els aminoàcids apolars a l’interior. Així, tenim a tothom content!
Mentre la proteïna es mantingui en un entorn amb aigua, la forma de pilota és ideal. De fet, és la disposició dels aminoàcids idònia perquè la proteïna pugui fer la seva funció. Si per les raons que sigui es perd aquesta estabilitat, es desplegarà, ja no podrà tornar mai més a la forma de pilota funcional i acabarà, inevitablement, sent degradada aminoàcid a aminoàcid, peça a peça.
Què hi té a veure tot això, amb el punt de neu?
Les proteïnes es poden desplegar per un augment de temperatura, un canvi brusc de pH, un canvi en l’entorn on es troben, etc. Aquest últim cas, és la clau de volta que ens explica el fenomen del punt de neu que ocorre quan batem les clares d’ou.
Una clara d’ou està formada en un 90% d’aigua amb un 10% de proteïnes dissoltes, entre les quals hi ha, essencialment, una proteïna anomenada albúmina. Es tracta d’una proteïna d’estructura terciària amb regions d’hèlix alfa, i té una estructura com la que podeu veure a la figura següent. Cada color representa un aminoàcid diferent i, si ens fixem, es pot deduir un cert patró al voltant de les hèlixs.
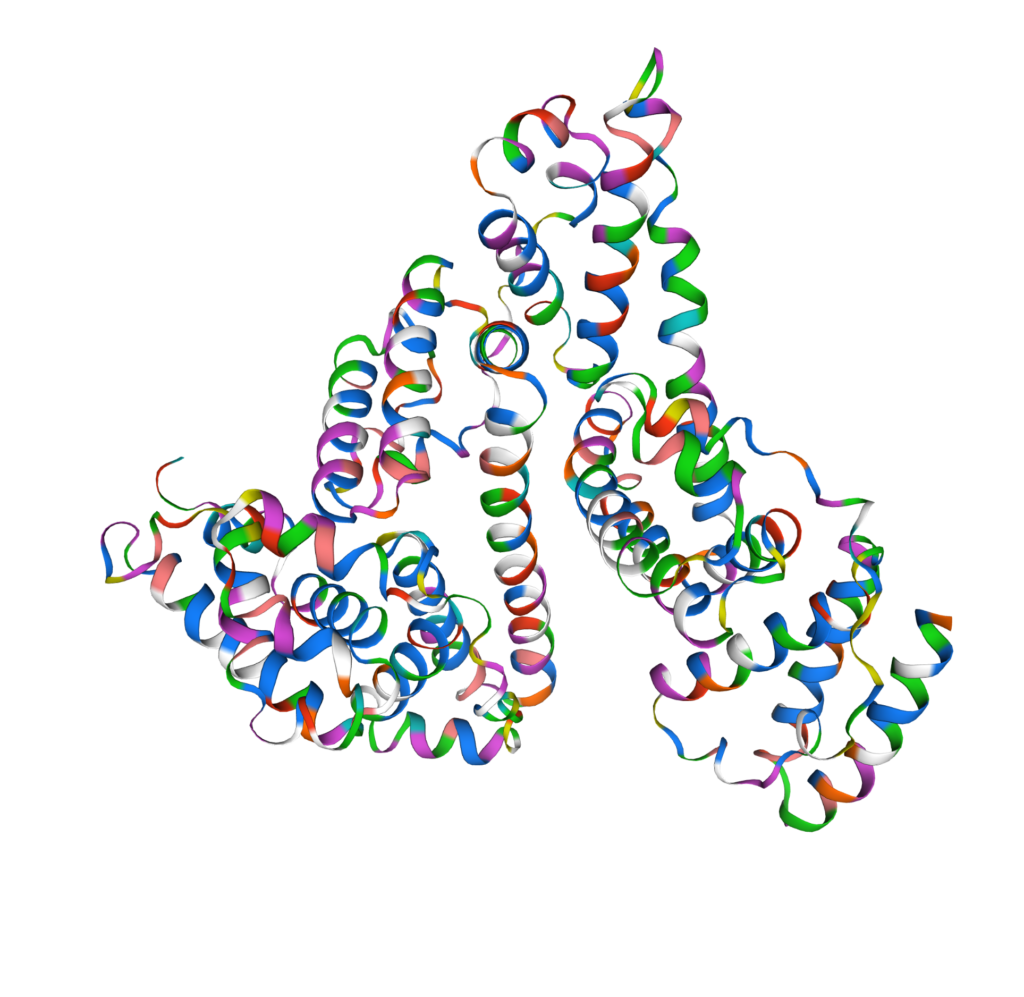
El procés per assolir el punt de neu és molt simple. D’entrada, l’albúmina es troba dissolta en aigua quan comencem a batre les clares (1). El medi polar doncs, és l’aigua, i el medi apolar és, sorprenentment, l’aire! Hem de tenir present que a l’interior de la proteïna hi ha els residus apolars (en groc) i a l’exterior, els polars (en lila) i que cadascun tendeix a agrupar-se amb els seus semblants.
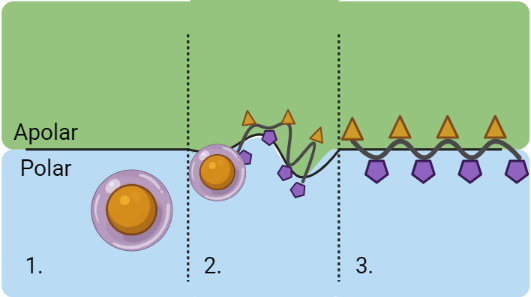
Quan comencem a batre, aigua i aire es mesclen formant bombolles d’aire envoltades per una interfase. És en aquesta interfase on els aminoàcids apolars es comencen a bellugar des de l’interior de la proteïna fins a la superfície, on entren en contacte amb aire per estar en un entorn més apolar (2) i on estan encara més còmodes que dins la pilota.
Així té lloc el desplegament irreversible de la proteïna (3), quan els compostos apolars queden en contacte amb l’aire apolar i els compostos polars, amb l’aigua polar. Ja no voldran tornar a dins la pilota.
La proteïna desplegada passarà a ocupar més espai perquè ja no estarà tan ordenada. A més a més, les interaccions entre les proteïnes desplegades ajudaran a mantenir el desgavell endreçat i estable, fent que augmenti el volum i la tensió. Així s’aconsegueix desafiar a llei de la gravetat: fent pinya per mantenir les superfícies de totes les bombolles d’aire plenes dels aminoàcids apolars alhora que es mantenen els aminoàcids polars dins l’aigua.
Ja per acabar…
Les proteïnes són unes biomolècules molt importants. Sense elles, no podríem ni respirar, ni moure’ns, ni obtenir energia; en definitiva, no podríem viure. Així doncs, és d’esperar que hi hagi moltes malalties relacionades amb les proteïnes i que, alhora, siguin protagonistes d’una bona part de la recerca més actual i rellevant.
És per això que és important veure les proteïnes i les seves propietats com una cosa que trobem fins i tot en accions tant quotidianes com batre uns ous. Tinguem l’edat que tinguem, és indispensable ser curiosos i no deixar mai d’experimentar i observar el que tenim a l’abast, per intentar entendre, cada dia una mica més, el complex món on vivim.
Per saber-ne més
Blood Cell Mol – Structure and function of hemoglobins
Exploratorium – The Science of Cooking
Khan Academy – Proteins and amino acids
La imatge de llavors i fruits secs prové de medicalnewstoday.com.
Les estructures proteiques s’han obtingut de la base de dades PDB.
Els esquemes s’han fet, ja sigui de zero o modificats, amb Biorender.com.







Molt interessant! El virus de l’herpes labial, tinc entès que necessita l’aminoàcid Arginina, ¿És correcte fer durant un temps (unes setmanes) una dieta pobre en Arginina per a què no es reprodueixi? (Les carn de les aus i carns vermelles són riques en Arginina i també els fruits secs).